Konsep Mol
Table of Contents
1. Konsep mol dan tetapan avogadro

Dalam dunia sekarang ini, pelajaran dari zat dan reaksi kimia memerlukan kemapuan untuk membaca menentukan sifat dari hasil reaksi kimia. Kita harus dapat menemukan rumus kimia dan menentukan seberapa banyak berbagai zat kimia di perlukan apabila kita akan melakukan reaksi kimia. Dengan kata lain, kita harus dapat bekerja secara kuantitatif dengan elemen, senyawa, dan reaksi kimia. Stoikhiometri (berasal dari bahasa yunani stoicheion = elemen dan metron = mengukur) adalah istilah yang di pakai dalam menggambarkan bentuk kuantitatif dari reaksi dan senyawa kimia.
Setiap reaksi kimia melibatkan atom dan molekul dalam jumlah yang besar. Misalnya akan membuat senyawa karbon dioksida, CO2. Dapat di lakukan dengan cara mereaksikan satu atom karbon dengan dua atom oksigen untuk mendapatkan satu molekul karbon dioksida.
C + O2 → CO2
Berapapun jumlah zat yang akan di reaksikan yang terpenting adalah perbandingan jumlah atom karbon dan oksigen haruslah 1 : 2. Jadi, kita perlu memiliki metode perhitungan yang tepat agar jumlah yang kita timbang mengandung atom dalam jumlah yang sesuai dengan perbandingan di atas. Oleh karena itu, untuk menyatakannya, para ahli kimia menggunakan “mol” sebagai satuan jumlah partikel (molekul, atom atau ion).
Mol adalah satuan banyaknya partikel atau merupakan penyederhanaan dari jumlah partikel. Ahli pertama kali yang menyatakan perlunya satuan jumlah partikel zat adalah avogadro . dari data percobaan yang dilakukan ternyata di peroleh bahwa 1 mol karbon -12 (12C) mengandung 6,0 x 1023 atom karbon -12 (12C). bilangan 6,02 x 1023 di sebut dengan bilangan avogadro, disingkat L. untuk zat yang membentuk unsur, satuan jumlah zat adalah atom, sedangkan senyawa satuannya adalah molekul.
Hubungan mol dengan jumlah partikel
Partikel ada 3 macam, yaitu atom, molekul dan ion. Unsur partikelnya berupa atom, senyawa berupa molekul, sedangkan unsur dan senyawa dalam bentuk ion partikelnya berupa ion.
Contoh ;
1 mol besi = L atom besi (besi adalah unsur)
2 mol besi = 2L atom besi
4 mol gas oksigen = 4L molekul oksigen (gas oksigen adalah senyawa)
3 mol ion kalium (K+) = 3L ion kalium (K+ ada;ah unsur berbentuk ion)
Pada contoh-contoh di atas, jumlah partikel berbanding lurus denga molnya, sehingga dapat di rumuskan :
Mol = jumlah partikel/ 6,02 x 1023 atau jumlah partikel = jumlah mol x 6,02 . 1023
Contoh soal;
hitunglah jumlah partikel dalam :
a. 2 mol unsur natrium
b. 3 mol H2O
c. 5 mol O2 !
Jawab :
Jumlah partikel = jumlah mol x 6,02 . 1023
a. 2 mol unsur natrium = 2 . 6,02 . 1023 = 1,204 . 1024
b. 3 mol H2O = 3 . 6,02 . 1023 = 1,806 . 1024 molekul H2O
c. 5 mol O2 = 5 . 6,02 . 1023 = 3,01 . 1024 molekul O2
2. Massa atom relatif (Ar)
Massa atom relatif (Ar) adalah angka-angka yang menunjukkan perbandingan massa antara satu atom dengan atom lain. Oleh karena massa atom relatif hanya nagka perbandingan, maka konsep massa atom relatif tidak mempunyai satuan.
Pada tahun 1961, IUPAC (International Union of Pure and Applied Chemistry) menetapkan isotop C-12 sebagai standar, sehingga massa atom lain di tentukan berdasarkan perbandingan terhadap masa atom C-12 tersebut. Berdasarkan hal ini, maka massa atom relatif di artikan sebagai perbandingan massa rata-rata 1 atom isotop suatu unsur dengan 1/12 kali massa 1 isotop atom C-12. Massa atom relatif secara matematika di rumuskan sebagai berikut :
Ar unsur X = massa rata-rata 1 atom unsur X / 1/12 massa 1 atom C-12
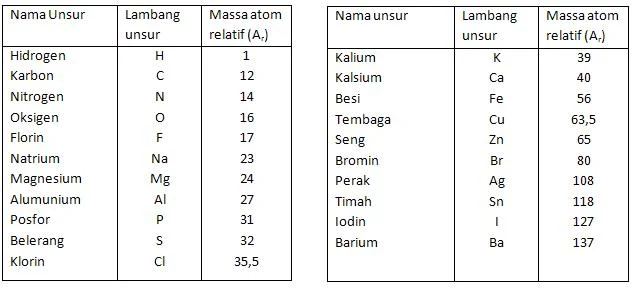
Harga massa atom relatif (A2) dari beberapa unsur, dapat di lihat pada tabel berikut.
Contoh soal :
Jika di ketahui massa 1 atom oksigen 2,70 x 10-23 g, berapakah Ar atom O jika massa atom C 1,99 x 10-23 g ?
Jawab :
Ar O = massa 1 atom O / 1/12 massa 1 atom karbon C-12
= 2,70 . 10-23 / 1/12 . 1,99 . 10-23 = 16,283 ≈ 16
Related: loading
3. Massa molekul relatif (Mr)
Molekul merupakan gabungan dari atom-atom. Molekul unsur merupakan gabungan dari atom-atom unsur sejenis, sedangkan molekul senyawa adalah gabungan dari ato-atom unsur yang berbeda jenis. Massa dari molekul dinyatakan sebagai massa molekul relatif (Mr), yaitu massa perbandingan antara massa rata-rata 1 molekul tersebut dengan massa rata-rata satu atom karbon C-12, sehingga dapat di rumuskan sebagai berikut.
Mr = Massa rata-rata 1 molekul senyawa / 1/12 massa 1 atom karbon C-12
Karena setiap molekul merupakan gabungan atom-atom, maka harga massa molekul relatif dari suatu senyawa juga merupakan jumlah dari massa atom relatif unsur-unsur penyusun senyawa tersebut.
Mr senyawa = jumlah atom x Ar masing-masing atom
Contoh soal :
Bila Ar H = 1,008, Ar O = 15,999 dan massa 1 atom 12C = 1,99 x 10-23 g, tentukan massa rata-rata 1 molekul air (H2O) !?
Jawab :
Mr senyawa = jumlah atom x Ar masing-masing atom
Mr H2O = 2 . Ar H + 1. Ar O
Mr H2O = 2 . 1,008 + 1 . 15,999
= 18,015
Mr = Massa rata-rata 1 molekul senyawa / 1/12 massa 1 atom karbon C-12
Mr H2O = massa rata-rata 1 molekul H2O / 1/12 massa 1 atom C-12
Massa rata-rata 1 molekul H2O = M2 H2O . 1/12 . massa 1 atom 12C
= 18,015 . 1/12 . 1,99 . 10-23 g
= 2,987 . 10-23 g
4. Massa molar
Massa satu mol zat sama dengan Ar atau Mr zat tersebut dalam sayuan gram per mol. Massa satu mol zat ini, selanjutnya di sebut massa molar. Untuk unsur yang partikelnya berupa atom, maka massa molar = Ar g/mol, sedangkan untuk senyawa yang partikelnya berupa molekul massa molar = Mr g/mol.
Rumus :
Massa molar zat = Ar atau Mr zat (gram/mol)
Contoh soal :
Tentukan massa molar 3 mol Fe dengan Ar Fe = 56 !
Jawab :
Massa molar Fe = 3 . Ar Fe = 3 . 56 = 168 gram
5. Volume molar gas
Dari percobaan data yang telah di lakukan di dapatkan bahwa satu liter gas Oksigen (O2) yang di ukur pada suhu 0o C dan tekanan 76 cmHg (1 atm) mempunyai massa sebesar 1,429 gram. Berdasakan hubungan massa dan mol, maka di peroleh jumlah mol O2 sebagai berikut.
Mol O2 = massa O2 / Mr O2 = 1,429/32 = 0,04466 mol
Berarti satu liter O2 = 0,04466 mol, sehingga volume satu mol O2 = 1/0,04466 liter = 22,4 liter.
Menurut hasil perhitungan tersebut dapat di simpulkan bahwa volume mol gas pada keadaan standar, yaitu suhu Oo C dan tekanan 1 atm besarnya adalah 22,4 liter. Secara umum dapat di rumuskan sebagai berikut.
Mol gas (STP) = volume gas(STP) /22,4 liter atau volume gas(STP) = jumlah mol x 22,4 liter
STP = standar temperature and pressure
Contoh soal :
Berapa volume 16 g gas O2 yang di ukur pada keadaan STP ? diketahui MrO2 = 32
Jawab :
Massa molar O2 = 32 g mol-1
Jumlah mol O2 = 16 g / 32 g.mol-1 = 0,5 mol
Pada STP volume molar O2 = 22,4 L mol-1.
Volume 0,5 mol O2 = 0,5 mol . 22,4 L mol-1 = 11,3 L
6. Hubungan jumlah partikel, massa zat, dan volume molar gas
Untuk mempermudah permudah perhitungan jumlah partikel dari massa molar atau volume molar gas dan sebaliknya, maka di buat skematis hubungan mol sebagai berikut.
Contoh soal :
Tentukan jumlah partikel zat berikut !
80 gram Ca (Ar Ca = 40)
Penyelesaian :
80 gram Ca =( gram Ca / Ar Ca ) mol
= 80/40 mol = 2 mol = 2 . (6,02 . 1023) atom Ca = 12,04 . 1023 atom Ca
7. Persamaan gas ideal
Volume gas pada suhu dan tekanan tertentu atau di ukur pada keadaan bukan standar dapat di tentukan dengan menggunakan persamaan gas ideal sebagai berikut.
PV = nRT atau V = nRT/P
Dimana : P = tekanan gas dalam atm
V = volume gas dalam liter
n = jumlah mol gas
R = tetapan gas = 0,082 liter atm/mol K
T = suhu mutlak gas dalam kelvin
Contoh soal :
Berapakah volume 40 gram SO3 (Mr = 80) yang di ukur pada suhu 127oC dan tekanan 4 atm?
Jawab :
N = massa SO3/ Mr SO3 = 40/80 = 0,5
T = 127 + 273 = 400o K
V = nRT/P = 0,5 . 0,08 . 400 / 4 = 4 liter

Posting Komentar